
Tamil Nadu Board 10th Standard Science - Chemistry Unit 7: Book Back Answers and Solutions
This post covers the book back answers and solutions for Unit 7 – Chemistry from the Tamil Nadu State Board 10th Standard Science textbook. These detailed answers have been carefully prepared by our expert teachers at KalviTips.com.
We have explained each answer in a simple, easy-to-understand format, highlighting important points step by step under the relevant subtopics. Students are advised to read and memorize these subtopics thoroughly. Once you understand the main concepts, you’ll be able to connect other related points with real-life examples and confidently present them in your tests and exams.
By going through this material, you’ll gain a strong understanding of Chemistry Unit 7 along with the corresponding book back questions and answers (PDF format).
Question Types Covered:
- 1 Mark Questions: Choose the correct answer, Fill in the blanks, Identify the correct statement, Match the following
- 2 Mark Questions: Answer briefly
- 3, 4, and 5 Mark Questions: Answer in detail
All answers are presented in a clear and student-friendly manner, focusing on key points to help you score full marks.
All the best, Class 10 students! Prepare well and aim for top scores. Thank you!
Topic: அணுக்களும் மூலக்கூறுகளும்
I. சரியான விடையைத் தேர்ந்தெடு.
1. கீழ்கண்டவற்றுள் எது குறைந்த நிறையைக் கொண்டது?அ) 6.023 × 1023 ஹீலியம் அணுக்கள்
ஆ) 1ஹீலியம் அணு
இ) 2 கி ஹீலியம் அணு
ஈ) 1 மோல் ஹீலியம் அணு
விடைகுறிப்பு:
ஆ) 1 ஹீலியம் அணு
2. கீழ்க்கண்டவற்றுள் எது மூவணு மூலக்கூறு?
அ) குளுகோஸ்
ஆ) ஹீலியம்
இ) கார்பன்டை ஆக்சைடு
ஈ) ஹைட்ரஜன்
விடைகுறிப்பு:
இ) கார்பன்டை ஆக்சைடு
3. திட்ட வெப்ப அழுத்த நிலையில் 4.4 கி CO2-ன் பருமன்
அ) 22.4 லிட்டர்
ஆ) 2.24 லிட்டர்
இ) 0.24 லிட்டர்
ஈ) 0.1 லிட்டர்
விடைகுறிப்பு:
ஆ) 2.24 லிட்டர்
4. 1 மோல் நைட்ரஜனின் அணுவின் நிறை
அ) 28 amu
ஆ) 14 amu
இ) 28 கி
ஈ) 14 கி
விடைகுறிப்பு:
ஈ) 14 கி
5. 1 amu என்பது
அ) C-12ன் அணுநிறை
ஆ) ஹைட்ரஜனின் நிறை
இ) ஒரு C-12ன் அணு நிறையில் 1/12 பங்கின் நிறை
ஈ) 0-16ன் அணு நிறை
விடைகுறிப்பு:
இ) ஒரு C-12ன் அணு நிறையில் 1/12 பங்கின் நிறை
6. கீழ்கண்டவற்றுள் தவறான கூற்று எது?
அ) 12 கிராம் C-12 ஆனது அவகாட்ரோ எண்ணிக்கையிலான அணுக்களைக் கொண்டது.
ஆ) ஒரு மோல் ஆக்சிஜன் வாயுவானது அவகாட்ரோ எண்ணிக்கையிலான மூலக்கூறுகளைக் கொண்டது.
இ) ஒரு மோல் ஹைட்ரஜன் வாயுவானது அவகாட்ரோ எண்ணிக்கையிலான அணுக்களைக் கொண்டது.
ஈ) ஒரு மோல் எலக்ட்ரான் என்பது 6.023 × 1023 எலக்ட்ரான்களைக் குறிக்கிறது.
விடைகுறிப்பு:
இ) ஒரு மோல் ஹைட்ரஜன் வாயுவானது அவகாட்ரோ எண்ணிக்கையிலான அணுக்களைக் கொண்டது.
7. திட்ட வெப்ப அழுத்த நிலையில் 1 மோல் ஈரணு மூலக்கூறு வாயுவின் பருமன்
அ) 11.2 லிட்ட ர்
ஆ) 5.6 லிட்டர்
இ) 22.4 லிட்டர்
ஈ) 44.8 லிட்டர்
விடைகுறிப்பு:
இ) 22.4 லிட்டர்
8. 20Ca40 தனிமத்தின் உட்கருவில்
அ) 20 புரோட்டான் 40 நியூட்ரான்
ஆ) 20 புரோட்டான் 20 நியூட்ரான்
இ) 20 புரோட்டான் 40 எலக்ட்ரான்
ஈ) 20 புரோட்டான் 20 எலக்ட்ரான்
விடைகுறிப்பு:
ஆ) 20 புரோட்டான் 20 நியூட்ரான்
9. ஆக்சிஜனின் கிராம் மூலக்கூறு நிறை
அ) 16 கி
ஆ) 18 கி
இ) 32 கி
ஈ) 17 கி
விடைகுறிப்பு:
இ) 32 கி
10. 1 மோல் எந்த ஒரு பொருளும் …. மூலக்கூறுகளைக் கொண்டிருக்கும்
அ) 6.023 × 1023
ஆ) 6.023 × 1023
இ) 3.0115 × 1023
ஈ) 12.046 × 1023
விடைகுறிப்பு:
அ) 6.023 × 1023
II. கோடிட்ட இடங்களை நிரப்பு.
1. இரு வேறு தனிமங்களின் அணுக்கள் ………….. நிறை எண்ணையும் ……………. அணு எண்ணையும் கொண்டிருந்தால் அவை ஐசோபார்கள் எனப்படும்.விடைகுறிப்பு:
ஒத்த, மாறுபட்ட
2. ஒரே ………………….. எண்ணிக்கையை பெற்றுள்ள வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோடோன்கள் எனப்படும்.
விடைகுறிப்பு:
நியூட்ரான்)
3. ஒரு தனிமத்தின் அணுக்களை மற்றொரு தனிமத்தின் அணுக்களாக …………….. முறையில் மாற்றலாம்.
விடைகுறிப்பு:
செயற்கை தனிமமாக்கல்
4. புரோட்டான்கள் மற்றும் நியூட்ரான்களின் கூடுதல் அந்த அணுவின் ……………. எனப்படும்.
விடைகுறிப்பு:
நிறை எண்
5. ஒப்பு அணுநிறை என்பது ……………… எனவும் அழைக்கப்படுகிறது.
விடைகுறிப்பு:
திட்ட அணு நிறை
6. ஹைட்ரஜனின் சராசரி அணு நிறை = ………
விடைகுறிப்பு:
1.008 amu
7. ஒரு மூலக்கூறானது ஒரே தனிமத்தின் அணுக்களால் உருவாக்கப்பட்டால் அவை ……….. எனப்படும்.
விடைகுறிப்பு:
ஒத்த அணு மூலக்கூறுகள்
8. ஒரு மூலக்கூறில் உள்ள அணுக்களின் எண்ணிக்கையே அம்மூலக்கூறின் …………….. ஆகும்.
விடைகுறிப்பு:
அணுக்கட்டு எண்
9. திட்ட வெப்ப அழுத்த நிலையில் ……………. மி.லி. இடத்தை அடைத்துக்கொள்ளக்கூடிய வாயு 1 மோல் எனப்படும்.
விடைகுறிப்பு:
22400
10. பாஸ்பரஸின் அணுக்கட்டு எண் = ……….
விடைகுறிப்பு:
4
III. பொருத்துக.
|
1.
|
8கி O2
|
அ.
|
4 மோல்கள்
|
|
2.
|
4 கிH 2
|
ஆ.
|
0.25 மோல்கள்
|
|
3.
|
52 கி Не
|
இ.
|
2 மோல்கள்
|
|
4.
|
112 கி N2
|
ஈ.
|
0.5 மோல்கள்
|
|
5.
|
35.5 கி Cl₂
|
உ.
|
13 மோல்கள்
|
|
1.
|
8கி O2
|
அ.
|
4 மோல்கள்
|
|
2.
|
4 கிH 2
|
ஆ.
|
0.25 மோல்கள்
|
|
3.
|
52 கி Не
|
இ.
|
2 மோல்கள்
|
|
4.
|
112 கி N2
|
ஈ.
|
0.5 மோல்கள்
|
|
5.
|
35.5 கி Cl₂
|
உ.
|
13 மோல்கள்
|
IV. சரியா? தவறா? (தவறு எனில் கூற்றினை திருத்துக)
1. இரு தனிமங்கள் இணைந்து ஒன்றுக்கு மேற்பட்ட சேர்மங்களை உருவாக்கும்
விடைகுறிப்பு:
சரி.
2. மந்த வாயுக்கள் அனைத்தும் ஈரணு மூலக்கூறுகள் ஆகும்.
விடைகுறிப்பு:
தவறு.
சரியான கூற்று: மந்த வாயுக்கள் ஓரணு தனிமங்கள்.
3. தனிமங்களின் கிராம் அணுநிறைக்கு அலகு இல்லை.
விடைகுறிப்பு:
தவறு.
சரியான கூற்று:
தனிமங்களின் கிராம் அணு நிறையை கிராமில் குறிப்பிடலாம்.
4. 1 மோல் தங்கம் மற்றும் 1 மோல் வெள்ளி ஆகியவை ஒரே எண்ணிக்கையிலான அணுக்களைக் கொண்டிருக்கும்.
விடைகுறிப்பு:
சரி.
5. CO2ன் மூலக்கூறு நிறை 42 கி.
விடைகுறிப்பு:
தவறு
சரியான விடைகுறிப்பு: CO2-ன் மோலார் நிறை 44 கி.
V. பின்வ ரும் வினாக்களில் கூற்றும் அதனையடுத்து காரணமும் கொடுக்கப்பட்டுள்ளன. பின்வருவனவற்றுள் எது சரியான தெரிவோ அதனைத் தெரிவு செய்க.
அ) A மற்றும் R சரி. R, A ஐ விளக்குகிறதுஆ) A சரி R தவறு.
இ) A தவறு R சரி.
ஈ) A மற்றும் R சரி. R, Aக்கான சரியான விளக்கம் அல்ல.
1. கூற்று A: அலுமினியத்தின் ஒப்பு அணுநிறை 27.
காரணம் R: ஒரு அலுமினியம் அணுவின் நிறையானது 1/12 பங்கு கார்பன்-12ன் நிறையைவிட 27 மடங்கு அதிகம்.
விடைகுறிப்பு:
ஈ) A மற்றும் R சரி. R, Aக்கான சரியான விளக்கம் அல்ல.
2. கூற்று A: குளோரினின் ஒப்பு மூலக்கூறு நிறை 35.5 amu.
காரணம் R: குளோரினின் ஐசோடோப்புகள் இயற்கையில் சம அளவில் கிடைப்பதில்லை.
விடைகுறிப்பு:
இ) A தவறு R சரி.
VI. சுருக்கமாக விடை யளி
1. ஒப்பு அணுநிறை – வரையறு.விடைகுறிப்பு:
1. ஒரு தனிமத்தின் ஒப்பு அணுநிறை என்பது அத்தனிமத்தின் சராசரி அணு நிறைக்கும் C-12 அணுவின் நிறையில் 1/12 பங்கின் நிறைக்கும் உள்ள விகிதமாகும்.
2. இது ‘Ar’ என்று குறிப்பிடப்படுகிறது.
3. இதனை திட்ட அணு எடை’ எனவும் அழைப்பர்.

விடைகுறிப்பு:
ஆக்ஸிஜனின் ஐசோடோப்புகள்
|
|
ஐசோடோப் |
சதவீத பரவல் (%) |
|
|
15.9949 |
99.757 |
|
|
16.9991 |
0.038 |
|
|
17.9992 |
0.205 |
2. அணுக்கட்டு எண் – வரையறு.
விடைகுறிப்பு:
1. மூலக்கூறில் உள்ள அணுக்களின் எண்ணிக்கையே அம்மூலக்கூறின் ” அணுக்கட்டு எண்’ ஆகும்.
2. இவை இரண்டு வகைப்படும். அவை
1. ஓரணு மூலக்கூறு,
2. ஈரணு மூலக்கூறு,
3. மூவணு மூலக்கூறு,
4. பல அணு மூலக்கூறு.
3. வேறுபட்ட ஈரணு மூலக்கூறுகளுக்கு இரண்டு எடுத்துக்காட்டு கொடு.
விடைகுறிப்பு:
1. HCl (ஹைட்ரஜன் குளோரைடு)
2. CO (கார்பன் மோனாக்சைடு)
4. வாயுவின் மோலார் பருமன் என்றால் என்ன?
விடைகுறிப்பு:
1. திட்ட வெப்ப அழுத்த நிலையில் (S.T.P) ஒரு மோல் வாயுவானது 22.4 லிட்டர் அல்லது 22400 மி.லி. பருமனை ஆக்கிரமிக்கும்.
2. இது மோலார் பருமன் எனப்படும்.
5. அம்மோனியாவில் உள்ள நைட்ரஜனின் சதவீத இயைபைக் கண்டறிக.
விடைகுறிப்பு:
அம்மோனியாவின் மூலக்கூறு வாய்ப்பாடு = NH3
NH3ன் கிராம் மூலக்கூறு நிறை
= [(14) + (3 × 1)] = 17 கி
அம்மோனியாவில் உள்ள நைட்ரஜனின் சதவீத இயைபு

VII. விரிவாக விடையளி.
1. 0.18கிநீர்துளியில் உள்ள நீர் மூலக்கூறுகளின் எண்ணிக்கையை கணக்கிடுக.விடைகுறிப்பு:
கொடுக்கப்பட்டவை:
நீரின் நிறை = 0.18கி
தீர்வு:
மூலக்கூறுகளின் எண்ணிக்கை


28, 6, 34.
3. மோல்களின் எண்ணிக்கையைக் கண்டறிக.
அ) 27 கி அலுமினியம்
ஆ) 1.51 × 1023 மூலக்கூறு NH4Cl
விடைகுறிப்பு:
அ) 27 கி அலுமினியம்
மோல்களின் எண்ணிக்கை

மோல்களின் எண்ணிக்கை
%20-%20Tamil%20Medium%20Guide.png)
4. நவீன அணுக்கொள்கையின் கோட்பாடுகளை எழுதுக. விடைகுறிப்பு:
1. அணு என்பது பிளக்கக்கூடிய துகள்
2. ஒரே தனிமத்தின் அணுக்கள் வெவ்வேறு அணு நிறைகளைப் பெற்றுள்ளன.
3. வெவ்வேறு தனிமங்களின் அணுக்கள் ஒரே அணுநிறைகளைப் பெற்றுள்ளன.
4. அணுவை ஆக்கவோ, அழிக்கவோ முடியாது. ஒரு தனிமத்தின் அணுக்களை மற்றொரு தனிமத்தின் அணுக்களாக மாற்ற முடியும்.
5. அணுவானது எளிய முழு எண்களின் விகிதத்தில் இருக்க வேண்டிய அவசியமில்லை.
6. அணு என்பது வேதிவினையில் ஈடுபடும் மிகச்சிறிய துகள்
7. ஒரு அணுவின் நிறையிலிருந்து அதன் ஆற்றலை கணக்கிட முடியும்.
5. ஒப்பு மூலக்கூறு நிறைக்கும் ஆவி அடர்த்திக்கும் உள்ள தொடர்பினை வருவி.
விடைகுறிப்பு:
ஒப்பு மூலக்கூறு நிறை:
ஒரு வாயு அல்லது ஆவியின் ஒப்பு மூலக்கூறு நிறை என்பது ஒரு மூலக்கூறு வாயு அல்லது ஆவியின் நிறைக்கும், ஒரு ஹைட்ரஜன் அணுவின் நிறைக்கும் இடையே உள்ள விகிதமாகும்.
ஆவி அடர்த்தி:
(i) மாறா வெப்ப மற்றும் அழுத்த நிலையில் ஒரு குறிப்பிட்ட பருமனுள்ள வாயு அல்லது ஆவியின் நிறைக்கும் அதே பருமனுள்ள ஹைட்ரஜன் அணுவின் நிறைக்கும் உள்ள விகிதமே ஆவி அடர்த்தி எனப்படும்.

%20-%20Tamil%20Medium%20Guide.png)
%20-%20Tamil%20Medium%20Guide.png)
(vi) ஹைட்ரஜன் ஈரணு மூலக்கூறு ஆதலால்,
%20-%20Tamil%20Medium%20Guide.png)
(vii) நாம் ஆவி அடர்த்தியை மூலக்கூறு நிறையுடன் கீழ்கண்டவாறு தொடர்புபடுத்தலாம்.
%20-%20Tamil%20Medium%20Guide.png)
(viii) சமன்பாடு 2-ஐ 1-ல் பிரதியிட,
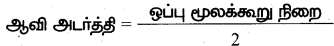%20-%20Tamil%20Medium%20Guide.png)
(ix) குறுக்கே பெருக்க, 2 × ஆவி அடர்த்தி = வாயு (அ) ஆவியின் ஒப்பு மூலக்கூறு நிறை (அ) ஒப்பு மூலக்கூறு நிறை = 2 × ஆவி அடர்த்தி
VIII. உயர்சிந்தனைக்கான வினாக்கள்.
1. கால்சியம் கார்பனேட்டை வெப்பப்படுத்தும்போது கீழ்க்கண்டவாறு சிதைவடைகிறது.CaCO3 → CaO + CO2
அ) இவ்வினையில் எத்தனை மோல்கள் கால்சியம் கார்பனேட் ஈடுபடுகிறது?
ஆ) கால்சியம் கார்பனேட்டின் கிராம் மூலக்கூறு நிறையைக் கணக்கிடு.
இ) இவ்வினையில் எத்தனை மோல்கள் கார்பன்டை ஆக்சைடு வெளிவருகிறது?
விடைகுறிப்பு:
அ) இவ்வினையில் 1 மோல் கால்சியம் கார்பனேட் ஈடுபடுகிறது.
ஆ) கால்சியத்தின் மோலார் நிறை = 40
கார்பனின் மோலார் நிறை = 12
ஆக்சிஜனின் மோலார் நிறை = 16
கால்சியம் கார்பனேட் (CaCO3)ன் கிராம் மூலக்கூறு நிறை = கால்சியத்தின் மோலார் நிறை + கார்பனின் மோலார் நிறை + ஆக்ஸிஜனின் மோலார் நிறை
= 40 + 12 + (16 × 3) = 100 கி/மோல்
இ) இவ்வினையில் 1 மோல் கார்பன்டை ஆக்சைடு வெளிவருகிறது.
IX. கணக்கீடுகள்.
1. கீழ்க்கண்டவற்றின் நிறையைக் காண்கஅ) 2 மோல்கள் ஹைட்ரஜன் மூலக்கூறு
ஆ) 3 மோல்கள் குளோரின் மூலக்கூறு
இ) 5 மோல்கள் சல்பர் மூலக்கூறு
ஈ) 4 மோல்கள் பாஸ்பரஸ் மூலக்கூறு
விடைகுறிப்பு:
அ) 2 மோல்கள் ஹைட்ரஜன் மூலக்கூறு
H2ன் மூலக்கூறு நிறை = 2
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை
= 2 × 2 = 4 கி
ஆ) 3 மோல்கள் குளோரின் மூலக்கூறு Cl2ன் மூலக்கூறு நிறை = 70.9
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை = 3 × 70.9 = 212.7கி
இ) 5 மோல்கள் சல்பர் மூலக்கூறு சல்பர் மூலக்கூறின் மூலக்கூறு நிறை = 32 × 8 = 256
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை
= 5 × 256 = 1280 கி
ஈ) 4 மோல்கள் பாஸ்பரஸ் மூலக்கூறு பாஸ்பரஸ் மூலக்கூறின் மூலக்கூறு நிறை = 31 × 4 = 124
நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை
= 4 × 124 = 496 கி
2. கால்சியம் கார்பனேட்டில் உள்ள ஒவ்வொரு தனிமத்தின் சதவீத இயைபைக் காண்க. (Ca = 40, C = 12, O = 16)
விடைகுறிப்பு:
CaCO3, ன் மோலார் நிறை

3. Al2(SO4)3 ல் உள்ள ஆக்சிஜனின் சதவீத இயைபைக் காண்க. (Al = 27, O = 16, S = 32).
விடைகுறிப்பு:
Al2(SO4)3 ன் மோலார் நிறை
= (27 × 2) + (32 × 3) + (16 × 12) = 342 கி
Al2(SO4)3ல் உள்ள O-ன் சதவீதம்
4. போரானின் சராசரி அணுநிறை 10.804 amu எனில் B-10 மற்றும் B-11 சதவீத பரவலைக் காண்க.
விடைகுறிப்பு:
B-10ன் சதவீத பரவல் = x
B-11ன் சதவீத பரவல்
B-11 = (100 – x)
போரானின் சராசரி அணுநிறை
10.804 × 100 = 1100 – x
1080.4 = 1100 – x
x = 1100 – 1080.4
x = 19.6%
B-10ன் சதவீத பரவல் = 19.6%
B-11ன் சதவீத பரவல்
B – 11 = (100 – x)
= 100 – 19.6
= 80.4%








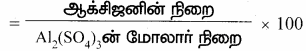
0 Comments:
Post a Comment